
Therapierbarkeit
Da eine vollständige Heilung der Mukopolysaccharidosen im Moment noch nicht wirklich erfolgen kann, kommen nur unterstützende und symptomatische Maßnahmen in Frage. Die Symptome variieren allerdings sehr hinsichtlich ihrer Ausprägung, die Behandlung muss sich deswegen ganz an den Symptomen des einzelnen Patienten orientieren.
Bei anstehenden Operationen muss man sich über die speziellen Anaesthesieprobleme im Klaren sein. Bei zwei Formen der MPS (MPS I und MPS VI) kann der Verlauf der Krankheit durch eine frühzeitige Knochenmarkstransplantation gemildert werden. Die größten Erwartungen bezüglich einer Heilung der MPS werden in die Gen-Therapie gesetzt, zur Zeit werden allerdings viel eher Erfolge mit der Enzymersatztherapie beobachtet.
Informationen zu:
Symptomatische Behandlung
– Orthopädische Probleme
Bezüglich des Bewegungs-Apparates wäre zu Physiotherapie und in gewissen Fällen zu orthopädischer Behandlung zu raten. Durch die Physiotherapie könnten verschiedene Symptome gemildert oder behoben werden, z.B. könnte die Bindegewebsschwäche durch Massage und Gymnastik beim Morbus Morquio zu einer Stärkung der Rückenmuskulatur führen. Auch die Versteifung von Gelenken, z.B. beim Morbus Hunter, könnte ein wenig hintan gehalten werden. Die orthopädische Behandlung umfasst chirurgische und konservative Maßnahmen. Das Ziel wäre, Deformierungen und Fehlstellungen von Knochen und Gelenken vorzubeugen bzw. bestehende Veränderungen zu korrigieren und zu stabilisieren.
Vor allem beim Morbus Morquio z.B. kann die Instabilität der Halswirbelsäule zu einer Querschnittslähmung führen. Eine Fusion (Fixierung der Wirbelkörper) sollte deshalb gemacht werden, noch bevor Lähmungserscheinungen festgestellt werden können. Manchmal kann man auch durch eine Dekompressionsoperation ohne Fusion Erfolge erzielen, doch kann es sein, dass diese Art der Operation nach einigen Jahren wiederholt werden muss.
Es gibt jedoch weltweit nur sehr wenige Ärzte, die sich dieser Sache besonders annehmen, sich auf diese Operationen spezialisiert haben und die bereits eine Reihe solcher Eingriffe erfolgreich durchgeführt haben. Andererseits ist es aber auch schon passiert, dass Kinder von anderen Ärzten operiert wurden und in der Folge querschnittgelähmt waren. Wir raten daher dringend, eine solch schwierige Operation nur in einem spezialisierten Zentrum durchführen zu lassen. Bitte bedenken Sie auch immer das stark erhöhte Narkoserisiko bei MPS-Kindern!
Für detaillierte Informationen steht die MPS Austria Gesellschaft gerne zur Verfügung:
entweder senden Sie ein Mail an office@mps-austria.at oder rufen uns an + 43-7249-47795.
Um dem Knochentransplantat bei einer Versteifung der Halswirbelsäule die Möglichkeit zu geben, korrekt mit der Schädelbasis zu verwachsen, ist es notwendig, Hals und Kopf in der richtigen Lage für einen Zeitraum von etwa vier Monaten ruhig zu stellen („halo“). Obwohl die Pflege eines solchen Patienten nicht gerade leicht ist, passen sich die Kinder recht gut an die neue Situation an.
Beim Morbus Scheie, Morbus Morquio und Morbus Maroteaux-Lamy sind im 2. oder 3. Lebensjahrzehnt manchmal Hüftoperationen nötig. Wegen der für MPS charakteristischen Hüftgelenksverformungen sind unter Umständen schon frühzeitig Hüftgelenksprothesen notwendig.
– Neurologische Probleme
Sehr schwierig ist es den neurologischen Problemen zu begegnen. Schlafstörungen beim M. Sanfilippo stellen eine besondere Herausforderung an die Familie dar. Hier kann man versuchen, Medikamente einzusetzen, die aber meist nur eine vorübergehende Besserung mit sich bringen. Beim Auftreten von Krampfanfällen (v.a. MPS III) muss medikamentös behandelt werden.
– Probleme im Augenbereich
Die Hornhauttrübung führt mitunter zu einer schweren Beeinträchtigung der Sehfähigkeit bei Patienten mit M.Hurler, M. Maroteaux-Lamy und M. Sly. Abhilfe kann eventuell eine Hornhauttransplantation schaffen.
– Probleme im HNO-Bereich
Mittelohrentzündungen treten häufig auf und sollen konsequent antibiotisch behandelt werden. Bei verschiedenen MPS treten sowohl eine Schallleitungsschwerhörigkeit als auch eine Innenohrschwerhörigkeit auf. Ersteres lässt sich durch Paukenröhrchen positiv beeinflussen, letzteres durch Hörgeräte. So kann ev. der Verlust des Sprachvermögens hinausgezögert werden, wenn es sich um eine MPS-Form handelt, die auch neurologisch betroffen ist.
Durch die Einlagerung von Mukopolysacchariden in Zunge, Kehlkopf und Luftröhre werden die Luftwege stark eingeengt. Das kann besonders im Schlaf zu Atempausen führen, die wiederum einen Sauerstoffmangel bewirken. Gegebenenfalls hilft die operative Verkleinerung der Nasenpolypen und Mandeln.
Durch die Deformierung des Brustkorbes oder durch die Vergrößerung von Leber und Milz, können die Atembewegungen eingeschränkt sein, sodass die Lungen nur unzureichend belüftet werden. Dies begünstigt das Auftreten von Lungenentzündungen. Eine frühzeitige Atemtherapie ist deshalb unbedingt anzuraten.
Anästhesie
Wenn es das erste Mal ist, dass Ihr Kind eine Operation oder eine Untersuchung unter Narkose (Anästhesie) braucht, dann möchten Sie sicherlich wissen, was dabei passiert. Es wird hier versucht, Ihnen einen kleinen Einblick über einen routinemäßigen Operationstag und die spezifischen Probleme, die bei Kindern mit MPS oder ähnlichen Erkrankungen vorkommen können, zu geben.
– Was ist eine Narkose?
Eine Narkose (Anästhesie) ist der Verlust von Empfindungen wie Schmerz oder Berührung. Eine lokale Narkose (Lokalanästhesie) macht nur den zu behandelnden Körperteil oder die zu operierende Stelle gefühllos, ansonsten ist das Kind wach und weiß, was passiert. Während einer Vollnarkose ist das Kind ohne Bewusstsein.
Der Arzt wird Ihnen erklären, welche Untersuchung oder Operation geplant ist. Bevor Sie Ihre Zustimmung zum geplanten Eingriff geben, sollten Sie sich auf keinen Fall scheuen, so viele Fragen zu stellen, wie nötig sind, um Ihnen die Sache verständlich zu machen. Man bespricht sich mit dem Narkosearzt (Anästhesisten). Dieser Arzt muss entscheiden, welche Art von Narkose für Ihr Kind die beste ist. Falls Ihr Kind schon einmal eine Operation hatte, können Sie dem Anästhesisten womöglich bereits wichtige Informationen über Ihr Kind, seine Erkrankung und die daraus resultierenden speziellen Probleme geben.
– Narkose eines Patienten – normales Vorgehen
Das Kind wird narkotisiert – entweder durch Verwendung von Narkose-Gas oder durch eine intravenöse Injektion. Bei manchen Operationen (z.B. im Bauchraum) wird ein Mittel verabreicht, das die gesamte Muskulatur (einschließlich der Atemmuskulatur) erschlaffen lässt. Sauerstoff wird vorübergehend durch eine Maske verabreicht, bis das Kind intubiert ist. Ein Instrument namens „Laryngoskop“ wird über den Mund eingeführt und nach hinten in den Rachen geschoben, so dass der Anästhesist den Eingang in den Kehlkopf überblicken kann.
Ein spezieller Schlauch (Tubus) wird dann über den Kehlkopf in die Luftröhre eingeführt und das Laryngoskop herausgezogen. Dieser Schlauch ist mit einer Maschine verbunden, die während der Dauer des Eingriffes die Lungen mit Sauerstoff versorgt.
– Narkose-Probleme bei MPS-Kindern
Es kann sehr schwierig sein, die Atemwege ausreichend offen zu halten, wie man schon während eines normalen Schlafes beobachten kann. Mit der zusätzlichen Erschlaffung der Muskulatur während einer Narkose kann sich die Verengung der Atemwege noch verstärken. Normalerweise umgeht man diese Schwierigkeiten durch das oben erwähnte Einlegen eines Schlauches durch den Kehlkopf, was aber bei MPS-Kindern recht schwierig sein kann. Alles, was es dem Narkosearzt erschwert, die Atmungswege offen zu halten, erhöht das Risiko einer Vollnarkose.
Viele Kinder mit MPS oder ähnlichen Erkrankungen haben folgende Probleme:
- Kurzer Hals (durch die Skelettveränderungen)
- Eingeschränkte Beweglichkeit von Kiefer und Hals
- Vergrößte und verdickte Zunge (durch die Speicherung)
- Verengte Atemwege (durch vermehrte Ablagerung von Mukopolysacchariden in den Schleimhäuten)
- Übermäßige Sekretbildung
- Unstabile Wirbelsäule, vor allem im Bereich der oberen Halswirbelsäule (besonders bei der MPS IV, dem Morbus Morquio)
- Schlaffe Trachea (Luftröhre)
- Ausleiten, besonders Extubation
Kinder mit Atemproblemen oder mit Herz- oder Lungenfehlern haben Schwierigkeiten, mit einer Narkose und ihren Nachwirkungen zurechtzukommen. Fast alle MPS-Kinder leiden unter derartigen Problemen. Auch kann es schwierig sein, eine Kanüle (Nadel) durch die dickere Haut zu bringen oder in die leicht zerreißbaren Venen einzuführen.
Was hat man zu beachten?
Sollte bei Ihrem Kind mit MPS eine Operation anstehen, so ist es ratsam, die Operation in einer Klinik machen zu lassen, die bereits Erfahrungen mit MPS-Kindern hat, auch wenn das unter Umständen bedeutet, dass man weitere Reisen auf sich nehmen muss. Es kann nämlich passieren, dass Ihr Kind nach einer Operation für einige Zeit an ein Beatmungsgerät angeschlossen werden muss. In diesem Fall ist eine Intensivstation mit geschulten Kinderärzten und –schwestern unbedingt notwendig. Die MPS-Gesellschaft berät Sie gerne – senden Sie uns ein Mail an office@mps-austria.at oder rufen Sie uns unter + 43-7249-47795 an.
Versichern Sie sich, ob der Narkosearzt die Krankheit Ihres Kindes und mögliche krankheitsbedingte Probleme kennt. Es gibt Möglichkeiten, die Probleme zu verringern, wie z. B. das Vermeiden spezifischer Narkosemittel oder die Stabilisierung des Halses/Vermeidung der Überstreckung des Kopfes bei Patienten mit Problemen mit der Halswirbelsäule. Die Intubation mit einem flexiblen Endoskop hat bei der Bewältigung schwieriger Intubationen große Vorteile.
Das Risiko einer Narkose muss immer mit dem zu erwartenden Vorteil der geplanten Operation oder Untersuchung abgewogen werden.
Chirurgische Eingriffe bei MPS-Kindern als Tagespatienten sind nicht ratsam, auch wenn es sich nur um eine Routine-Operation handelt.
Es heißt nicht, dass gerade bei Ihrem MPS-Kind, überhaupt wenn es noch klein ist, diese Probleme auftreten müssen. Viele Kinder mit MPS und ähnlichen Erkrankungen haben bereits chirurgische Eingriffe gut überstanden und ihre Lebensqualität hat sich dadurch wesentlich verbessert.
Knochenmarkstransplantation
Durch eine Knochenmarkstransplantation kann der Verlauf mancher Mukopolysaccharidosen gemildert werden. Angewendet wird diese Behandlung v.a. bei M.Hurler und bei M. Maroteaux-Lamy. Bei den anderen Formen konnte bisher keine Besserung erzielt werden.
Diese Behandlung ist mit verschiedenen Problemen verbunden:
-
- Zum Ersten muss ein Spender gefunden werden, der die gleichen Gewebs-Eigenschaften wie der Patient hat. Oft ist das nur bei Geschwistern der Fall. Sind keine Geschwister vorhanden, gestaltet sich die Suche nach einem geeigneten Fremdspender schwierig und langwierig.
- Zum Zweiten ist eine Konditionierung (Chemotherapie) notwendig, um das eigenen Knochenmark größtmöglichst auszulöschen. Damit ist eine Verminderung der Abwehrkraft des Körpers und ein hohes Infektionsrisiko verbunden.
- Und zum Dritten kann es auch seitens des Knochenmarks zu einer Abwehrreaktion der neuen Spenderzellen gegen die Zellen des Empfängers kommen (Graft-versus-host-Reaktion). Zeichen dafür sind Haut- und Darmblutungen, Leberversagen, Schock. Selbst das Medikament, das gegen diese Reaktion eingesetzt wird, kann zu Nebenwirkungen wie Bluthochdruck und Niereninsuffizienz führen.
Eine Knochenmarkstransplantation ist eine schwer in den Organismus eingreifende Maßnahme, und das Risiko muss eingehend gegen den zu erwartenden Erfolg abgewogen werden.
Verläuft die Behandlung erfolgreich, so darf man sich über keine Heilung, sondern über eine Linderung des natürlichen Krankheitsverlaufes freuen:
-
- Die mentale Entwicklung kann auf dem Niveau gehalten werden, das zur Zeit des Eingriffs gegeben war
- Die Vergrößerung von Leber und Milz gehen zurück
- Die Gelenksversteifungen bilden sich zurück
- Die Sehfähigkeit und das Hörvermögen bessern sich
- Die Hornhauttrübung bildet sich zurück
- Ein Wachstum ist möglich
- Die schweren Skelettveränderungen werden allerdings nur wenig beeinflusst.
Eine Knochenmarkstransplantation sollte in einem sehr jungen Alter, am besten vor dem zweiten Lebensjahr (bis zum 18. Lebensmonat) durchgeführt werden.
Gentherapie
In diese Behandlung werden große Hoffnungen gesetzt. Allerdings steht uns eine Gentherapie noch nicht zur Verfügung – auch wenn in der Forschung bereits große Erfolge erzielt und die ersten klinischen Studien durchgeführt wurden.
Grundsätzlich müssen bei der Gentherapie Kopien eines normalen Gens in ein Trägerpartikel, den sogenannten Vektor eingebaut werden, um zu garantieren, dass die therapeutischen eingebrachten Gene tatsächlich in der Lage sind, die Krankheitsursache zu beseitigen. Zwei unterschiedliche Grundstrategien, die „in-vivo“ oder „ex-vivo“-Methoden können dazu angewandt werden.
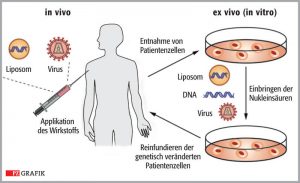
Bei der „In-vivo“ Therapie werden Vektoren eingesetzt, die aus Adenoviren entwickelt wurden (adeno-associated vectors, AAV). Sie sind so verändert, dass sie zwar in Zellen eindringen und die therapeutische DNA in den Zellkern einschleusen, sich selbst aber nicht mehr vermehren können. Sie sind speziell für Zelltypen mit langer Lebensdauer und geringer Teilungsaktivität, wie Nerven- und Muskelzellen, geeignet. Es wird das für die Therapie nötige Gen, nicht aber der Virus-Anteil des Vektors in die Patienten-DNA eingebaut.
Damit kann die Gefahr einer unbeabsichtigten Aktivierung von Tumorwachstum minimiert werden, bei einer Zellteilung geht das therapeutisch wirksame Gen allerdings verloren.
Bei den ex-vivo Verfahren, werden den Patienten Knochenmark-Stammzellen entnommen und in Zellkultur mit einem Vektortyp behandelt, der in das genetische Material der Zellen integriert wird (Lentivirale Vektoren). Die Stammzellen werden in Zellkultur genetisch korrigiert und vermehrt und können dann in großer Menge dem Patienten wieder infundiert werden.

Hier ist ein Link zu einem Artikel von Prof. Dr. Eduard Paschke, erschienen im MPS-Falter 2014, wo er unter dem Titel „Gentherapie ist klinische Realität“ diese Thematik näher beschreibt und auch auf verschiedene bestehende Konzepte einer möglichen Verwirklichung eingeht.
Enzymersatztherapie
Das Prinzip der Enzymersatztherapie besteht darin, dass den Patienten das fehlende Enzym in regelmäßigen Abständen mittels Infusionen zugeführt wird. Das Problem hierbei ist aber das Überwinden der Bluthirnschranke, sodass die Wirkung auf das Zentralnervensystem zur Zeit kaum möglich ist..
Hergestellt wird das Enzym mittels einer Zellkultur. Dazu wurden in der Vergangenheit Ovarien-Zellen des chinesischen Hamsters eingesetzt. Heute verwendet man dazu humane Hautfibroblasten oder Pflanzenzellen. Die Zellen werden in großen Reaktoren (Fermentoren) unter optimalen Wachstumsbedingungen (Temperatur, pH, Sauerstoff etc.) gezüchtet. Damit sie das benötigte Enzym produzieren können, müssen sie zunächst mit der richtigen genetischen Information versorgt werden. Dies geschieht, indem man jene Genabschnitte des menschlichen Gens, welche für die Herstellung des gewünschten Enzyms verantwortlich sind, in die Zellen der Gewebekultur verpflanzt. Unter Umständen produziert diese so veränderte sogenannte rekombinante Hamsterzelle dann das gewünschte Enzym.
Nach der Fermentation muss das Enzym aus dem Gemisch der anderen Proteine abgetrennt werden. In gereinigtem Zustand kann es dann als Therapeutikum eingesetzt werden.
Das erste so produzierte Enzym, das als Medikament den Namen Aldurazyme (abgeleitet von Alpha-L-Iduronidase, dem Enzymdefekt bei MPS I) trägt, wurde am 10. Juni 2003 in Europa durch die Europäische Zulassungsbehörde genehmigt. In den USA wurde es bereits am 30. April 2003 zugelassen.
Für die MPS-Forschung war das ein großartiger Durchbruch und eine große Hoffnung für die Patienten, besonders wenn man bedenkt, dass von der ersten Grundlagenforschung im Labor von Prof. Elisabeth Neufeld/ USA bis zur Zulassung des Medikaments ganze 35 Jahre vergangen sind. Im Rahmen von klinischen Studien (Phase I, II und III) wurden den Patienten das Enzym in Form von Infusionen verabreicht. Was sich dabei gezeigt hat, das waren vor allem signifikante Verbesserungen im Bereich der Gelenke (Versteifungen nahmen ab), eine Reduktion der Leber- und Milzgröße und ebenfalls eine positive Beeinflussung der Atempausen im Schlaf. Allerdings gibt es keinen Hinweis darauf, dass auch die Speicherungen im Gehirn beeinflusst werden können.
Aldurazyme® wurde von den Firmen BioMarin und Genzyme im Rahmen eines Joint Venture entwickelt, wobei BioMarin für die Herstellung und Genzyme für die weltweite Vermarktung verantwortlich ist. Auch für MPS II, MPS VI und MPS IVA gibt es mittlerweile zugelassene Medikamente für die Enzymersatztherapie. Elaprase für MPS II wurde 2006 zugelassen, Naglazyme für MPS VI folgte 2007 und im Jahr 2014 kam die Zulassung für Vimizim für MPS IVA.
In der klinischen Studie für MPS VI war schon in der Phase I ab dem Jahr 2000 neben fünf Kindern aus den USA auch ein österreichisches Kind involviert. In der klinischen Studie für MPS IVA konnten in der Phase 3 sogar drei österreichische Patienten an den Studienstandorten London und Mainz teilnehmen.
Das Überwinden der Blut-Hirn-Schranke stellt nach wie vor ein großes Problem dar und ist mit herkömmlicher EET nicht ausreichend möglich. Es gibt daher neue Entwicklungen und Versuche, das Enzym direkt ins Gehirn bzw. ins Nervenwasser zu injizieren, was in diversen klinischen Studien getestet wird. Mehr dazu im Kapitel Forschung unter „Neue Therapien bei MPS„.
